|
|
|
 b
b
Mit untenstehenden Links können Sie direkt in das entsprechende Kapitel springen.
Inhalt
Rationale
Antibiotikatherapie: Antibiotic Stewardship!
Aktueller
Stand: Shut-down 2020 nach Schadsoftware
Geschichte
und Entwicklung des ABx Programms
Zukünftige
Entwicklung & aktuelle Übergangslösung
Adaptierte "Bundles"
der Surviving Sepsis Campaign für Sepsis und septischen Schock
Antibiotika-Therapiegrundsätze Sepsis
Kalkulierte
Initialtherapie bei unbekanntem Erreger
Empirische antimykotische Therapie
Spezielle
Entitäten: gezielte Antibiotikatherapie nach Erregernachweis
Einige Beispiele aus der Literatur
Rationale Antibiotikatherapie: Antibiotic Stewardship!
Seit nunmehr über 20 Jahren beschäftigt sich die
interdisziplinäre Arbeitsgruppe ABx mit der Weiterentwicklung eines
webbasierten Empfehlungsprogramm zur Behandlung von Infektionen in der
Intensiv- und Notfallmedizin. Das ABx-Programm stellt in erster Linie
evidenzbasierte Empfehlungen unter Berücksichtigung von nationalen und
internationalen Leitlinien für die kalkulierte antimikrobielle Therapie zur
Verfügung und transferiert diese in ein nutzerfreundliches, elektronisches
Format. ABx war und ist ein Antibiotic-Stewardship Initiative und wäre ohne ein
großes Netzwerk an Mitarbeitenden nicht möglich.
Die aktuelle Website wurde im Rahmen des
Hauptstadtkongresses Anästhesie und Intensivmedizin, HAI 2012, in neuer
zeitgemäßer Form der Fachöffentlichkeit vorgestellt. Es ist unser Anliegen, den
Kolleginnen und Kollegen vor Ort ein effizientes Instrument zur rationalen
Antiinfektivatherapie bereitzustellen. Um den Zugriff weiter zu erleichtern,
erfolgte die Programmierung einer Mobilversion für Smartphones und Tablets,
welches die Nutzung direkt im Intensivbereich unabhängig von der Klinik-IT
ermöglicht.
Aktueller Stand: Shut-down 2020 nach Schadsoftware
Am 11. März 2020 wurde die Anwendung durch eine
Schadsoftware infiltriert und musste vom Netz genommen werden. Nach erster
Analyse wäre eine umfangreiche Bearbeitung nötig, um den Dienst wieder
aufzunehmen.
Gegenwärtig besteht also kein Zugang
zum System, was alle Autoren und Mitarbeiter sehr bedauern. Als Interimslösung
finden Sie hier eine temporäre Aufschlüsselung von den Inhalten, die am
häufigsten nachgefragt wurden. Trotz der statischen Form dieser
Antibiotika-Fibel als Essenz des ABx Programms ist der Text für Sie hoffentlich
eine Unterstützung.
PD. Dr. Irit Nachtigall & PD. Dr.
Sascha Tafelski
Univ. Prov. Dr. med. Claudia Spies
für das ABx-Team
Geschichte und Entwicklung des ABx Programms
Die Idee des ABx Programms stammt
bereits aus den 1990er Jahren und wurde 2005 nach diversen Vorarbeiten intensiv
umgesetzt. Mit dem Entwurf von Schnittmustern und Entscheidungs-Algorithmen
nahm die Entwicklung ihren Anfang.
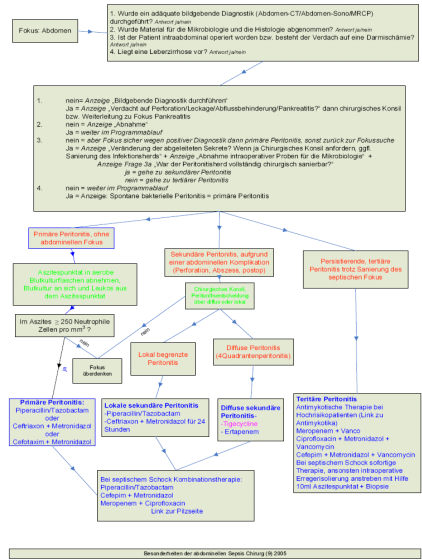
Schlussendlich wurde aus dem ersten
Programmentwurf eine Webbasierte Anwendung und spätestens 2012 mit der
Vorstellung auf dem HAI war ABx Teil der Antibiotikastrategie in vielen
Kliniken deutschlandweit und Gegenstand von Forschungskooperationen in der DGAI
sowie der ESICM.

Zukünftige Entwicklung & aktuelle Übergangslösung
In den vergangenen Monaten wurde in der Deutschen Gesellschaft für Infektiologie (https://www.dgi-net.de) eine gemeinsame Entwicklung einer Plattform für eine webbasierte Antibiotic Stewardship Initiative gestartet. Unter Federführung von Prof. Dr. Jörg Janne Vehreschild wird hier ein Programm entstehend, in das die zentralen Elemente der ABx Anwendung integriert werden und welches gleichzeitig über den Inhalt von ABx hinaus gehen wird. Aktuell ist geplant, entsprechende Inhalte auf der Internetpräsenz https://infektiopedia.de/ zu hinterlegen.
Aktuell ist der Zugriff auf
diesen Dienst noch nicht möglich. Als Zwischenlösung für die aktuellen Anwender
von ABx wird deshalb der nachfolgende Leitfaden zur Antibiotokatherapie zur
Verfügung gestellt.
ABx-Fibel
Sepsis in der
Intensivmedizin
Klinisches Bild*
Patienten mit Sepsis sind schwer krank:
Sepsis ist ein infektiologischer Notfall!
Das Fortschreiten lokal begrenzter Infektionen hin zu einem
systemischen Krankheitsbild wird unter dem Begriff Sepsis zusammengefasst.
Dabei ist die Sepsis als lebensbedrohliche Organdysfunktion
charakterisiert und wird pathophysiologisch durch eine dysregulierte
immunologische Reaktion auf die Infektion unterhalten. Neben dem Sepsis-Konzept
der Bakteriämie (u.a. Hugo Schottmüller 1913) hat auch das SIRS - Konzept (
u.a. Bone 1991) weiterhin eine klinische Bedeutung.
Die Antibiotikatherapie ist nur ein Teil der
Sepsis-Therapie: Im Vordergrund stehen Fokusidentifikation und Fokussanierung
sowie die konsequente Anwendung des „1-Stunden-Bündel “.
Klinische Situationen
Sepsis stellt das pathophysiologische Korrelat der schwersten Verlaufsform im Prinzip aller Infektionen dar. Am häufigsten sind Pneumonien, abdominelle Infektionen oder Harnwegsinfektionen Ursache der Sepsis. Dabei ist wichtig zu bemerken, dass das frühe Erkennen und das Aufhalten der Kaskade die Prognose deutlich verbessert. Vorherrschend ist das Organversagen, welches beim septischen Schock auch mit einem protrahierten Kreislaufversagen vergesellschaftet ist.
|
Definition Sepsis-3 |
|
· Sepsis: lebensbedrohliche Organdysfunktion aufgrund einer fehlregulierten Wirtsantwort bedingt durch eine Infektion · Organdysfunktion: akute Veränderung des SOFA-Scores ≥2 Punkte als Folge einer Infektion (bei Patienten ohne vorbekannte Organdysfunktion Ausgangs-SOFA-Score=0) · septischer Schock: Vasopressorengabe erforderlich, um bei persistierender Hypotonie einen MAD ≥65 mmHg aufrechtzuerhalten und Serum-Laktat >2 mmol/l trotz adäquater Volumensubstitution |
Diagnostik
Diagnosekriterien
Um das Kontinuum von lokaler Infektion bis hin zum Septischen Schock abzubilden,
könnte vereinfacht wie folgt eingeteilt werden:
1. Schwere Infektion: Infektionsverdacht + ≥ 2 SIRS-Kriterien
2. Sepsis: Infektionsverdacht + ≥ 2 Punkte SOFA Anstieg
3. Septischer Schock: Sepsis + Vasopressorbedarf (um MAP >65mmHg zu halten) und Serum-Laktat > 2 mmol/l (trotz adäquater Volumensubstitution)
Bei unbekanntem SOFA-Score soll ein
Ausgangs-SOFA von 0 Punkten angenommen werden.
Diagnostische Schritte
|
Mikrobiologische Diagnostik |
|
Basisdiagnostik · mindestens 2 (besser 3) Blutkulturpaare (siehe Handlungsempfehlung Blutkultur-Diagnostik) · ohne Vorhandensein zentraler Gefäßzugänge: mind. 2 Blutkulturpaare (besser 3) perkutan von unterschiedlichen Entnahmestellen · bei Vorhandensein zentraler Gefäßzugänge: mind. 1 Blutkulturpaar (besser 2) perkutan (oder via neu platziertem i.v.-Zugang) und zusätzlich je 1 Blutkulturpaar von jedem seit >48 h in situ befindlichen, zentralen Gefäßzugang (ZVK, Port, Vorhofkatheter, art. Katheter) |
|
Fokus Atemwege · respiratorische Sekrete (Tracheobronchialsekret oder BAL, wenn diese klinisch indiziert ist, [Sputum]) auf Erreger+Resistenz · Legionellen-Antigentest (aus Urin) · während Influenza-Saison bzw. bei Reiseanamnese: Influenza-Diagnostik (Molekularbiologische Testung, AG-Schnelltest nicht empfohlen) aus NasopharynxAbstrich oder respiratorischem Sekret, ggf. ergänzt um saisonale spezifische Diagnostik (z.B. COVID-19) · Pleurapunktat auf Erreger + Resistenz in sterilem Gefäß und in Blutkulturflaschen |
|
Fokus Harntrakt · Urin-Status · Urinkultur auf Erreger + Resistenz |
|
Zusätzliche Mikrobiologische Diagnostik |
|
Allgemein: - Intravasale Katheterspitzen (Ausrolltechnik) nur bei Infektionsverdacht und gleichzeitiger Einsendung von Blutkulturen (möglichst zentral und peripher gleichzeitig entnommen: Differential Time to Positivity) - grundsätzlich sind Gewebeproben und/oder Punktate zu bevorzugen, da die diagnostische Validität von Abstrichen zu gering ist Fokus Gefäßkatheter (ZVK, Port, Vorhofkatheter etc.) · Katheter nach Desinfektion ziehen/operativ entfernen Fokus Wunde/Naht/Abszess · Wunde/ Naht öffnen und Material (Gewebe> Punktat> Abstrich) auf Erreger + Resistenz · (Abszess-)Punktat auf Erreger + Resistenz in sterilem Gefäß und in Blutkulturflaschen Fokus Gelenke · Gelenkpunktat auf Erreger + Resistenz in sterilem Gefäß und in Blutkulturflaschen, außerdem Bestimmung/Differenzierung Zellzahl im Labor Fokus Abdomen (Galle, Darm) · Aszitespunktat auf Erreger + Resistenz in sterilem Gefäß und in Blutkulturflaschen · DD: schwere C. difficile-Infektion → Stuhlprobe zur Clostridioides-Diagnostik unter Berücksichtigung einer optimalen Transportzeit zum Labor (max. 2 h wegen hitzelabilem Toxin) einsenden, Toxin und E+R Fokus ZNS · V.a. auf Meningitis: Liquorpunktion (Erreger+Resistenz und HSV-PCR) |
Beispiele für Differentialdiagnosen
Jede Form von systemischer Reaktion des Körpers, ohne dass eine Infektion vorliegt, die mit einer Organdysfunktion einher geht. Beispiele hierfür sind ödematöse Pankreatitis, schweres Trauma, Toxic-Shock-Syndrom, Verbrennungen oder postoperative systemische Inflammationsreaktion.
Die hämophagozytische
Lymphohistiozytose, kurz HLH, ist eine lebensbedrohliche
Funktionsstörung des Immunsystems, die mit Hyperinflammation, Zytokinsturm und
unkontrollierter Aktivierung von Lymphozyten und Makrophagen einhergeht. Zur
Diagnostik dient hier eine Ferritinbestimmung während eines
septischen Schocks bei Erstdiagnose und dann alle 7 Tage und ist bedeutsam, da
als therapeutische Konsequenz eine Immunsuppression erfolgen muss.
Erreger*
Typische bakteriellen Erreger der Sepsis sind nachfolgend
angegeben, wobei regionale Unterschiede sowie die Reiseanamnese relevante
Faktoren sind.
|
Fokus |
häufige Erreger |
|
Unbekannt - ambulant erworben |
S. aureus, Streptokokken, E. coli, Enterokokken,
Klebsiella spp., Pseudomonas spp. |
|
Unbekannt
- nosokomial
erworben |
S. aureus, E. coli, andere Enterobacteriaceae, Enterokokken, Pseudomonas
aeruginosa |
|
Atemwege
- ambulant
erworben sCAP |
Pneumokokken, H.
influenzae, S.
aureus, Enterobacteriaceae, Pseudomonas aeruginosa3) |
|
Atemwege
- nosokomial
erworben |
S. aureus, E. coli, andere Enterobacteriaceae, Pseudomonas
aeruginosa3), Anaerobier |
|
Harnwege |
E.
coli, Proteus mirabilis, Enterokokken, Enterobacteriaceae Pseudomonas
aeruginosa, Staphylokokken |
|
Abdominelle
Infektionen, gynäkologische
Organe |
E.
coli/ andere Enterobacteriaceae, Enterokokken, Anaerobier. Pseudomonas
aeruginosa |
|
Haut-
/Weichgewebe nekrotisierende
Fasziitis Fourniersche
Gangrän |
A-Streptokokken,
S. aureus Mischinfektionen
(zusätzlich mit Non-A-Streptokokken, Anaerobier, Enterobacteriaceae,
Pseudomonas aeruginosa) |
|
Gefäßkatheter (ZVK,
Port, Dialysekatheter) |
koag.-neg.
Staphylokokken, S. aureus, gramnegative Stäbchen, Candida spp.,
Corynebakterien, Propionibakterien |
Therapie
Kausale Therapie
Sepsis Patienten sollten innerhalb einer Stunde nach Stellen der Verdachtsdiagnose Sepsis einer kausalen Therapie zugeführt werden:
1. Sanierung von Infektionsherden (operative Sanierung; endoskopische oder radiologisch gesteuerte Einlage von Spüldrainagen; Wechsel intravenöser Katheter durch Neupunktion, insbesondere bei einer Liegedauer >48h; ggf. Entfernung von Tenckhoff-Kathetern, Ports, o.ä)
2. Erregerspezifische, resistenzgerechte oder kalkulierte Antibiotikatherapie
Adaptierte "Bundles" der Surviving Sepsis Campaign für Sepsis und septischen Schock
Unter der Zielsetzung, die Letalität der schweren Sepsis um 25% zu reduzieren, hat die Surviving Sepsis Campaign (SSC) mehrfach sogenannte "Bundles" entwickelt. Darunter versteht man Gruppen von evidenzbasierten Interventionen, deren gemeinsame Anwendung das Outcome stärker verbessert, als die Anwendung der einzelnen Interventionen alleine.
Das "Hour-1-Bundle" beinhaltet Ziele, die möglichst innerhalb der ersten Stunde nach Diagnose Sepsis erreicht sein sollten. Dabei wurde zuletzt das 3-Stunden-Bundle und das 6-Stunden-Bundle der Surviving Sepsis Campaign zu einem Maßnahmenpaket zusammengefasst.
Zusammenfassung "1-Stunden-Bündel"
1.Lactat bestimmen
2. Entnahme von Blutkulturdiagnostik möglichst vor Gabe der Antibiotika
Blutkulturentnahme vor Beginn der Antibiotikatherapie bzw. vor Umstellung der Antibiotikatherapie (siehe auch ABx Programm: Blutkulturen müssen nach adäquater Hautdesinfektion über > 1 min steril entnommen werden. Die Wahrscheinlichkeit der Isolierung eines im Blut vorhandenen Erregers steigt mit der Menge des untersuchten Blutes. Deshalb möglichst an unterschiedlichen Stellen 2 Serien/Blutkultursets (Serie =1 aerobe + 1 anaerobe Flasche) in kurzem zeitlichen Abstand aus unterschiedlichen peripheren Venenpunktionen für die Kultivierung entnehmen. Pro Flasche 8 - 10ml Blut einsetzen. Bei Kulturen aus bereits liegenden Kathetern bestehen sehr hohe Kontaminationsraten. Nur bei frisch gelegtem ZVK ist die Entnahme einer Kultur über diesen Zugang sinnvoll. Bei Verdacht auf katheter-assoziierte Sepsis 1. Entnahme aus dem Katheter, 2. Entnahme aus peripherer Vene! Entnahmezeit notieren und dem Labor mitteilen, damit die Differenzzeit zwischen den Entnahmezeiten berechnet werden können! Flaschen sollten nicht belüftet werden.)
3. Applikation von Breitspektrum-Antibiotika (Erregerspezifische, resistenzgerechte oder kalkulierte Antibiotikatherapie)
4. Volumengabe: Applikation von 30 ml/kg kristalloider Infusionslösungen bei Hypotension oder erhöhtem Lactatspiegel ≥4 mmol/l. Zur Volumentherapie sollten nach aktuelle Nutzen-/Risikoanalysen aufgrund erhöhter Mortalität und Nierenschädigung keine Kolloidlösungen mehr verwendet werden (z.B. HAES 130/0,4 6%). Die Gabe von Humanalbumin sollte nur nach strenger individueller Indikationsstellung erfolgen, sie kann bei septischem Schock diskutiert werden.
5. Vasopressoren: Applikation von Vasopressoren (Noradrenalin, ggf. Vasopressin bei hohen Katecholamindosierungen), wenn die Hypotension während oder nach der Gabe der Kristalloide weiterbesteht, um einen mittleren arteriellen Druck von (MAP) ≥65 mm Hg zu erzielen
Antibiotika-Therapiegrundsätze Sepsis
Die
Behandlung von Patienten mit Sepsis orientiert sich primär an den Empfehlungen
bei den entsprechenden Erkrankungsbildern. Dennoch bestehen bei der Sepsis
einige Besonderheiten, die nachfolgend aufgeführt sind. Die Studienlage zeigt
jedoch klar, dass Patienten mit septischem Schock oder kritisch kranke
Patienten im Sinne des 1-Stunden-Bündel aggressiver behandelt werden sollten.
|
· Die Identifizierung des Sepsisfokus und dessen schnellstmögliche (innerhalb 6-12 Stunden nach Diagnosestellung) Sanierung (möglichst invasiv/chirurgisch oder interventionell-radiologisch) sollte immer angestrebt werden! · unverzügliche Entfernung aller intravaskulärer Zugänge, die als Fokus für die Sepsis in Betracht kommen · kalkulierte, initial intravenöse Antibiotikatherapie - innerhalb 1 (septischer Schock) bis max. 3 Stunden nach Diagnosestellung Sepsis: Fokus v.a. auf Vermeidung einer Verzögerung zwischen Zeitpunkt der ärztlichen Entscheidung und Verabreichung des Antibiotikums · Berücksichtigung antibiotischer Vorbehandlungen in den letzten 3 Monaten sowie MRE-Kolonisation/-Vorinfektionen/-Kontakt und lokale MRE-Epidemiologie ·
initiale Antibiotikatherapie: “Hit hard and
early”: Häufig wird eine Kombinationstherapie
notwendig sein, um das relevante Erregerspektrum zu erreichen. Für Empfehlungen zur initialen, empirischen
Kombinationstherapie liegen Konsensempfehlungen vor (z.B. S2K Leitlinie
Sepsis 2018) und bleibt intensiv diskutiert. Relevant ist das Erfassen des
kausalen Erregers besonders im septischen Schock und gleichzeitig die Vermeidung einer antibiotischen
Übertherapie! · Re-Evaluation der Antibiotikatherapie 48-72 h nach Beginn und dann alle 48 h |
|
·
Deeskalation: v nach
Erhalt mikrobiologischer Befunde möglichst frühe
Umstellung auf eine gezielte
Schmalspektrum-Therapie v Deeskalation
nach klinischer Besserung sowie unter Monitoring von z.B. Procalcitonin
im Verlauf (optimal unter Nutzung eines PCT-Algorithmus; Stopp bei
>80%igem PCT-Abfall gegenüber dem am höchsten gemessenen Wert bzw. bei
einem Wert ≤0,25 ng/l) v initiale
Kombinationstherapie 3-5 Tagen auf eine ß-Laktam-Monotherapie reduzieren auch
ohne Erregernachweis ·
Applikationsform: o prolongierte Gabe (=Infusionsdauer: 3-4 h/Dosis) von ß-Laktam-Antibiotika nach Bolus. Bei Verfügbarkeit eines TDM ist eine kontinuierliche Gabe der ß-Laktam-Antibiotika (ebenfalls nach einer initialen Standarddosis als Bolus) möglich. ·
Therapiebeendigung
in der Regel nach 7 (-10)
Tagen wirksamer Therapie o Ausnahmen bei Indikationen für verlängerte Antibiotikatherapien: · persistierender Infektion (z.B. fehlende chirurgische Fokuskontrolle ) ·
tiefer Fokus wie z.B. Endokarditis,
Meningitis, Hirnabszess, Spondylodiszitis oder Osteomyelitis · S.aureus-Bakteriämien (i.v.-Therapie 14d bis zu 28d!, s. SOP S. aureus-Bakteriämie), · Infektionen durch Listerien, Borrelien, Pneumocystis, Tropheryma whippeli, Actinomyzeten, Mykobakterien · Pat. mit verzögertem Therapieansprechen · Pat. mit invasiven Pilzinfektionen (s. SOP Systemische antimykotische Prophylaxe und Therapie) · Pat. mit bestimmten Virusinfektionen · Pat. mit Immundefizienz wie beispielsweise Neutropenie |
Kalkulierte Initialtherapie bei
unbekanntem Erreger
|
|
|||
|
Fokus |
häufige
Erreger |
Beispiel Therapie-Empfehlung Sepsis |
MRGN
Risiko oder Septischer
Schock |
|
Unbekannt - ambulant erworben |
S. aureus, Streptokokken, E. coli, Enterokokken,
Klebsiella spp., Pseudomonas spp. |
·
Piperacillin/Tazobactam |
· Cefotaxim/
Ceftriaxon + Ciprofloxacin · Meropenem bei MRSA Risiko: Vancomycin
oder Linezolid |
|
Unbekannt
- nosokomial
erworben |
S. aureus, E. coli, andere Enterobacteriaceae, Enterokokken, Pseudomonas
aeruginosa |
·
Piperacillin/Tazobactam ·
Meropenem + ·
Vancomycin |
·
Meropenem + Ciprofloxacin ·
Meropenem + Tobramycin ·
Piperazillin/Tazobactam + Ciprofloxacin, ·
Pipperazillin/Tazobactam + Tobramycin Bei MRS Risiko: Vancomycin oder
Linezolid |
|
Atemwege
- ambulant
erworben sCAP |
Pneumokokken, H.
influenzae, S.
aureus, Enterobacteriaceae, Pseudomonas aeruginosa3) |
·
Piperacillin/Tazobactam ·
Ceftriaxon ·
Cefotaxim + ·
Aminoglykosid (Azithromycin) (für
<drei Tage empirisch bis atypische Erreger ausgeschlossen) |
Die Wahrscheinlichkeit für MRGN in
dieser Patientenpopulation ist sehr gering. In Einzelfällen, wie z.B.
multi-morbide Patienten mit Tracheostoma und vorbekannter MRGN-Kolonisation,
sollten 4MRGN ggf. kalkuliert entsprechend des letzten Resistogrammes mit
erfasst werden. ·
Piperacillin/Tazobactam
+ Fluorchinolon [Ciprofloxacin, Levofloxacin] Bei MRSA Risiko: Vancomycin oder
Linezolid |
|
Atemwege
- nosokomial
erworben |
S. aureus, E. coli, andere Enterobacteriaceae, Pseudomonas
aeruginosa3), Anaerobier |
·
Piperacillin/Tazobactam ·
Meropenem + ·
Vancomycin |
·
Meropenem + Aminoglykosid
[Tobramycin, Amikacin] ·
Ceftazidim* + Aminoglykosid
[Tobramycin, Amikacin] ·
Piperacillin/Tazobactam
+ Aminoglykosid [Tobramycin, Amikacin] ·
Carbapenem
[Meropenem, Imipenem] + Fluorchinolon [Ciprofloxacin, Levofloxacin] ·
Piperacillin/Tazobactam
+ Fluorchinolon [Ciprofloxacin, Levofloxacin] + ·
Vancomycin oder Linezolid |
|
Harnwege |
E.
coli, Proteus mirabilis, Enterokokken, Enterobacteriaceae Pseudomonas
aeruginosa, Staphylokokken |
·
Piperacillin/Tazobactam ·
Meropenem |
·
Meropenem + ·
Vancomycin oder Linezolid |
|
Abdominelle
Infektionen, gynäkologische
Organe |
E.
coli/ andere Enterobacteriaceae, Enterokokken, Anaerobier. Pseudomonas
aeruginosa |
·
Piperacillin/Tazobactam ·
Meropenem |
·
Meropenem + Vancomycin |
|
Haut-
/Weichgewebe nekrotisierende
Fasziitis Fourniersche
Gangrän |
A-Streptokokken,
S. aureus Mischinfektionen
(zusätzlich mit Non-A-Streptokokken, Anaerobier, Enterobacteriaceae,
Pseudomonas aeruginosa) |
·
Piperacillin/Tazobactam
+ Clindamycin ·
Meropenem + Clindamycin |
Rufbereitschaft Mikrobiologie bei
z.B. V.a. Gasbrand ! Weichgewebeinfektionen Typ I und II
sowie bei Fournierscher Gangrän ·
Piperacillin/Tazobactam ·
Meropenem + Penicillin G (bis zum Ausschluss
von Clostridien) (Bei Penicillinallergie
alternativ anstelle Penicillin G bei Clostridien: Ceftriaxon oder Erythromycin) |
|
Gefäßkatheter (ZVK,
Port, Dialysekatheter) |
koag.-neg.
Staphylokokken, S. aureus, gramnegative Stäbchen, Candida spp.,
Corynebakterien, Propionibakterien |
·
Piperacillin/Tazobactam
+ Vancomycin ·
Meropenem
+ Vancomycin |
-
Vancomycin + Meropenem -
Vancomycin + Ceftazidim |
1) Risiko für MRGN:
a. schwere strukturelle chronische Lungenerkrankungen (schwere COPD, Bronchiektasen, Mukoviszidose) mit Antibiotikavortherapie oder vorausgegangener Hospitalisierung jeweils in den letzten drei Monaten
b. bekannte Kolonisation (P. aeruginosa, MRSA, MRGN)
c. PatientInnen aus Langzeitpflegebereichen, chronische Dialyse, Tracheostomaversorgte, offene Wunden
d. vorhergehende Hospitalisation
e. vorhergehende antibiotische Therapie (in Abhängigkeit von Spektrum, Dauer und Dosierung)
Empirische antimykotische Therapie
Candida - Infektionen sind
ätiologisch relevant bei Patienten mit Sepsis und im septischen Schock. Bei
intraabdominalem Nachweis aus Histologie oder Mikrobiologie bzw. bei Candidämie
antimykotische Therapie beginnen. Bei Nichtansprechen der antibiotischen Therapie
innerhalb von 24- 48h ist die zusätzlich antimykotische Therapie z.B. mit
Echinocandinen empfohlen.
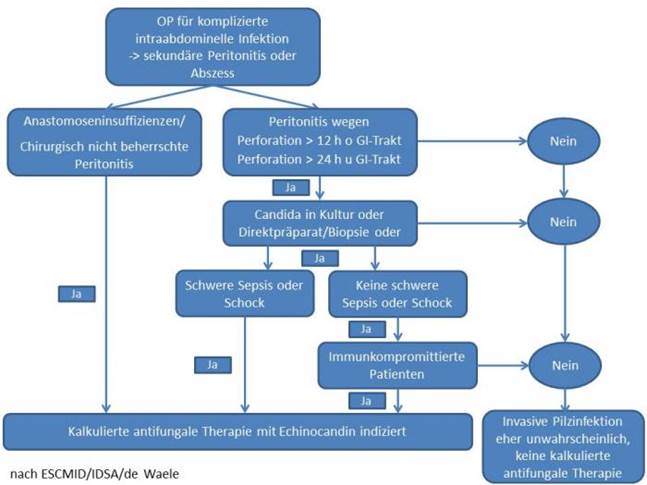
Spezielle Entitäten: gezielte Antibiotikatherapie nach
Erregernachweis
|
|
||||
|
Erreger |
Therapieempfehlung2)/ Alternativen nachgeordnet |
Kombinationspartner |
||
|
S.aureus MSSA |
Flucloxacillin (6 x 2g/d) |
ggf. 12 g/24 h kontinuierlich nach Bolus, TDM! |
bei Vorhandensein nicht infizierter (sicherer Ausschluss!) oder nicht entfernbarer Fremdmaterialien (z.B. intrakardiale Devices/Herzklappen, Endoprothesen, Osteosynthesen, implantierte Pumpen): + Rifampicin (2 x 450 mg/d)3) oder Fosfomycin (3 x 5 g/d) |
|
|
Cefazolin (3 x 2 g/d) |
|
|||
|
S.aureus MRSA koagulase-negative Staphylok. |
Vancomycin (2 x 1 g/d)4) |
ggf. 30 mg/kg KG/24 h kontinuierlich nach Bolus (15mg kgKG) TDM! |
bei Vorhandensein nicht infizierter (sicherer Ausschluss!) oder nicht entfernbarer Fremdmaterialien (z.B. intrakardiale Devices/Herzklappen, Endoprothesen, Osteosynthesen, implantierte Pumpen, …): + Rifampicin (2 x 450 mg/d)3) oder Fosfomycin (3 x 5 g/d) |
|
|
Daptomycin 1 x 10 mg/kg KG/d |
|
bei Vorhandensein nicht infizierter (sicherer Ausschluss!) oder nicht entfernbarer Fremdmaterialien (z.B. intrakardiale Devices/Herzklappen, Endoprothesen, Osteosynthesen, implantierte Pumpen, …): + Rifampicin (2 x 450 mg/d)3) oder Fosfomycin (3 x 5 g/d) |
||
|
Linezolid (2 x 600 mg/d) |
|
Cave: KEINE Kombination mit Rifampicin! hierunter beschleunigter Abbau und somit eventueller Wirkverlust von Linezolid |
||
|
S.aureus-Bakteriämie |
Therapie wie oben angeführt über mind. 14 d (nach 1. neg. Folgeblutkultur) , bei komplizierter S.aureus-Bakteriämie mind. 28 d (s. SOP S.aureus-Bakteriämie) |
|
||
|
A-Streptokokken |
Penicillin G (4-6-8 x 5 Mio IE/d) |
+ Clindamycin (4 x 600 mg/d) |
||
|
Cefazolin (3 x 2 g/d) - bei Penicillin-Allergie |
||||
|
|
||||
|
Erreger |
Therapieempfehlung2)/ Alternativen nachgeordnet |
Kombinationspartner |
||
|
Pneumokokken |
Penicillin G (4-6-8 x 5 Mio IE/d) |
+ Azithromycin (1 x 500mg/d) – für 3 Tage und nur bei pulmonalen Fokus |
||
|
Ceftriaxon (2 x 2 g/d) - bei Penicillin-Allergie oder Penicillin-Resistenz |
||||
|
Enterococcus faecalis |
Ampicillin (4 x 3 g/d) |
|
||
|
Vancomycin (2 x 1g/d)4) - bei Penicillin-Allergie |
ggf. 30 mg/kg KG/24 h kontinuierlich nach Bolus TDM! |
+ ggf. Gentamicin (5 - 10 mg/kg/d)6) - bei Ausschluss einer High-Level-Resistenz |
||
|
Enterococcus faecium |
Vancomycin (2 x 1 g/d)4) |
ggf. 30 mg/kg KG/24 h kontinuierlich nach Bolus TDM! |
+ ggf. Gentamicin (5 - 10 mg/kg/d)6) - bei Ausschluss einer High-Level-Resistenz |
|
|
Daptomycin 1 x 10 mg/kg KG/d |
|
|
||
|
Linezolid (2 x 600 mg/d) |
|
|
||
|
E. coli, Klebsiella spp., Proteus mirabilis |
Ampicillin/Sulbactam (4 x 3 g/d) |
3 MRGN, 4 MRGN: nur nach individuellem Antibiogramm |
||
|
Ceftriaxon (1 x 2 g/d) |
||||
|
Ciprofloxacin (3 x 400 mg/d) |
||||
|
Citrobacter, Enterobacter, Serratia |
Meropenem (3 x 1-2g/d) |
ggf. nach Initialbolus weiter mit Meropenem 6 g/24h als kontinuierliche Infusion TDM! |
|
|
|
Ciprofloxacin (3 x 400 mg/d) |
||||
|
Pseudomonas aeruginosa |
Ceftazidim (3 x 2 g/d) |
ggf. nach Initialbolus weiter mit 6 g/24 h kontinuierlich TDM! |
ggf. + Ciprofloxacin (3 x 400 mg/d) oder + Fosfomycin (3 x 5 g ) 3 MRGN, 4 MRGN: nur nach individuellem Antibiogramm |
|
|
Meropenem ( 3x 1-2g/d) |
ggf. nach Initialbolus weiter mit Meropenem 6 g/24h als kontinuierliche Infusion TDM! |
|||
|
Acinetobacter spp. |
Meropenem ( 3x 1-2g/d) |
ggf. nach Initialbolus weiter mit Meropenem 6 g/24h als kontinuierliche Infusion TDM! |
ggf. + Ciprofloxacin (3 x 400 mg/d) 3 MRGN, 4 MRGN: nur nach individuellem Antibiogramm |
|
|
Stenotrophomonas maltophilia |
Cotrimoxazol (2-3 x 960 mg/d) |
ggf. + Levofloxacin (2 x 500 mg/d) |
||
1) Dosierungsangaben für erwachsene Patienten mit normaler bis kompensierter Nierenfunktion (GFR >50 ml/min)
Einige Beispiele aus der Literatur
·
WHO Resolution zur Sepsis:
http://apps.who.int/gb/ebwha/pdf_files/WHA70/A70_R7-en.pdf?ua=1
• S2k Leitlinie: Kalkulierte
parenterale Initialtherapie bakterieller Erkrankungen bei Erwachsenen – Update
2018 (AWMF 082-006)
• S2k LeitlinieSepsis – Prävention,
Diagnose, Therapie und Nachsorge. https://www.awmf.org/leitlinien/aktuelle-leitlinien/ll-liste/deutsche-sepsis-gesellschaft-ev.html
• Singer
et al. The Third International Consensus Definitions for Sepsis and Septic
Shock (Sepsis-3). JAMA; 2016
• Levy
MM, Evans LE, Rhodes A. The Surviving Sepsis Campaign Bundle: 2018 update.
Intensive Care Med. 2018. doi: 10.1007/s00134-018-5085-0
• Shankar-Hari
M, Phillips GS, Levy ML, Seymour CW, Liu VX, Deutschman CS, et al., Developing
a New Definition and Assessing New Clinical Criteria for Septic Shock: For the
Third International Consensus Definitions for Sepsis and Septic Shock
(Sepsis-3). Jama. 2016;315(8):775-87
• Rhodes
A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al., Surviving
Sepsis Campaign: International Guidelines for Management of Sepsis and Septic
Shock: 2016. Intensive Care Med. 2017;43(3):304-77
• Vardakas
KZ, Voulgaris GL, Maliaros A, Samonis G, Falagas ME. Prolonged versus
short-term intravenous infusion of antipseudomonal beta-lactams for patients
with sepsis: a systematic review and meta-analysis of randomised trials. Lancet
Infect Dis. 2018;18(1):108-20
• Martinez
ML, Ferrer R, Torrents E, Guillamat-Prats R, Goma G, Suarez D, et al., Impact
of Source Control in Patients With Severe Sepsis and Septic Shock. Crit Care
Med. 2017;45(1):11-9
• Seymour
CW, Gesten F, Prescott HC, et al. Time to Treatment and Mortality during
Mandated Emergency Care for Sepsis. N Engl J Med 2017; 376: 2235–44.
• Pruinelli
L, Westra BL, Yadav P, et al. Delay Within the 3-Hour Surviving Sepsis Campaign
Guideline on Mortality for Patients With Severe Sepsis and Septic Shock. Crit
Care Med 2018; published online Jan 2. DOI:10.1097/CCM.0000000000002949
• Bretonnière
C, Leone M, Milési C, Allaouchiche B, Armand-Lefevre L, Baldesi O, et. al.
Strategies to reduce curative antibiotic therapy in intensive care units (adult
and paediatric). Intensive Care Med. 2015;41(7):1181-96
·
Bone RC et al.. Definitions for sepsis and
organ failure and guidelines for the use of innovative therapies in sepsis. The
ACCP/SCCM Consensus Conference Committee.American College of Chest
Physicians/Society of Critical Care Medicine. Chest. 1992 Jun;101(6):1644 - 55
·
Singer M, Deutschman CS,
Seymour CW, et al. The Third International Consensus
Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801–810.
doi:10.1001/jama.2016.0287
·
Dellinger RP, Carlet JM, Masur H, Gerlach
H, Calandra T, Cohen J, Gea-Banacloche J, Keh D, Marshall JC, Parker MM et al:
Surviving Sepsis Campaign guidelines for management of severe sepsis and septic
shock. Intensive
Care Med 2004, 30(4):536 - 555.
·
Reinhart K, Brunkhorst FM
et al., Prävention, Diagnose, Therapie und Nachsorge der Sepsis 1. Revision der
S-2k Leitlinien der Deutschen Sepsis-Gesellschaft e.V. (DSG) und der Deutschen
Interdisziplinären Vereinigung für Intensiv- und Notfallmedizin DIVI),
Anaesthesist. 2010 Apr;59(4):347 - 70.
·
Effectiveness of treatments for severe
sepsis: a prospective, multicenter, observational study. Ferrer R, Artigas A,
Suarez D, Palencia E, Levy MM, Arenzana A, Pérez XL, Sirvent JM; Edusepsis
Study Group. Am J Respir Crit Care Med.
2009 Nov 1;180(9):861 - 6.
·
Characteristics and Determinants of
Outcome of Hospital-Acquired Bloodstream Infections in Intensive Care Units:
The EUROBACT International Cohort Study.
Tabah, A., et al.
Intensive Care Med. 2012, 38, 1930–1945.
Hämophagozytische
Lymphohistiozytose
·
Tothova Z, Berliner N. Hemophagocytic Syndrome and
Critical Illness: New Insights into Diagnosis and Management. Journal of
intensive care medicine 2015; 30: 401-412.
·
Henter JI,
Horne A, Arico M, Egeler RM, Filipovich AH,et al. HLH-2004: Diagnostic and
therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatric
blood
·
Lachmann, G., La Rosée,
P., Schenk, T. et al. Anaesthesist (2016) 65: 776.
https://doi.org/10.1007/s00101-016-0216-x
Literatur aus dem ABx
Team
·
Pneumonia in paediatric critical care medicine
and the adherence to guidelines Tafelski S, et al. Minerva Pediatr 2019. PMID 31621272
·
Frequency, predictive factors and therapy of emergence delirium: data from
a large observational clinical trial in a broad spectrum of postoperative
pediatric patients Doerrfuss JI, et al. Minerva Anestesiol 2019. PMID 30665281 Free article.
·
Observational clinical study on organ dysfunction associated with dosing of
antibiotics in a Pediatric Intensive Care Unit Tafelski S, et al. Minerva Pediatr 2018. PMID 27830927
·
Underestimated and Modifiable? From Intraoperative Drug Application to
Postoperative Infections Tafelski S, et al. Anesthesiology 2016. PMID 27649437
·
Obesity in critically ill patients is associated with increased need of
mechanical ventilation but not with mortality Tafelski S, et al. J Infect Public Health 2016.
PMID 26754202 Free article.
·
Look at the patient--in sugar and infection Tafelski S, et al. Crit Care 2015. PMID 26715534
Free PMC article.
·
Effect of blood-sugar limitation on intensive care mortality: Intragroup
evaluation Nachtigall I, et al. J Int Med Res 2015 - Clinical Trial. PMID
25998625
·
Randomized controlled clinical trial evaluating multiplex polymerase chain
reaction for pathogen identification and therapy adaptation in critical care
patients with pulmonary or abdominal sepsis Tafelski S, et al. J Int Med Res 2015 - Clinical Trial. PMID
25911587
·
Observational clinical study on the effects of different dosing regimens on
vancomycin target levels in critically ill patients: Continuous versus
intermittent application Tafelski S, et al. J Infect Public Health 2015 - Clinical Trial.
PMID 25794497
·
Impact of multiplex PCR on antimicrobial treatment in febrile neutropenia:
a randomized controlled study Idelevich EA, et al. Med Microbiol Immunol 2015 - Clinical Trial.
PMID 25573349
·
Long-term effect of computer-assisted decision support for antibiotic
treatment in critically ill patients: a prospective 'before/after' cohort study
Nachtigall I, et al. BMJ Open
2014 - Clinical Trial. PMID 25534209 Free PMC article.
·
Comparison of three models for sepsis patient discrimination according to
PIRO: predisposition, infection, response and organ dysfunction Tafelski S, et al. Minerva Anestesiol 2015. PMID
25220552
·
Standard operating procedures for antibiotic therapy and the occurrence of
acute kidney injury: a prospective, clinical, non-interventional, observational
study Nachtigall I, et al. Crit Care
2014 - Clinical Trial. PMID 24923469 Free PMC article.
·
Polymorphisms of the toll-like receptor 2 and 4 genes are associated with
faster progression and a more severe course of sepsis in critically ill patients
Nachtigall I, et al. J Int Med
Res 2014. PMID 24366499
·
Timing is everything Edel A, et al. J Cardiothorac Vasc Anesth 2012. PMID 22445179
·
Gender-related outcome difference is related to course of sepsis on mixed
ICUs: a prospective, observational clinical study Nachtigall I, et al. Crit Care 2011 - Clinical Trial. PMID 21693012
Free PMC article.
·
One fits all and never change a winning team: the need for balanced
strategies in antibiotic therapy Tafelski S, et al. Crit Care Med 2011. PMID 21330872
·
Computer-assisted decision support for changing practice in severe sepsis
and septic shock Tafelski S, et al. J Int Med Res 2010. PMID 21309474
·
[Evidence-based anti-infective program "ABx" - Online-program for
anti-infective therapy broadens functions for local adaptations] Tafelski S, et al. Anasthesiol Intensivmed
Notfallmed Schmerzther 2009. PMID 19629910
·
Impact of adherence to standard operating procedures for pneumonia on
outcome of intensive care unit patients Nachtigall I, et al. Crit Care Med 2009. PMID 19050600
Impressum:
Das ABx Team wurde durch eine ganze Reihe von Kolleginnen
und Kollegen entwickelt und getragen, was an dieser Stelle nicht unerwähnt
bleiben soll. In einer Folgeversion dieses Artikels wird deren Mitarbeit entsprechend
gewürdigt werden.
Anbieter: Charité - Universitätsmedizin Berlin, Zentrale
Postanschrift: Charitéplatz 1, 10117 Berlin, Programm-Leitung: Prof.
Dr. med. Claudia Spies, Augustenburger Platz 1,13353 Berlin,Telefon: +49 30 450
– 551001, Fax: +49 30 450 - 551909
Haftung für Inhalte: Die Inhalte unserer
Seiten wurden mit größter Sorgfalt erstellt. Für die Richtigkeit,
Vollständigkeit und Aktualität der Inhalte können wir jedoch keine Gewähr
übernehmen. Als Diensteanbieter sind wir gemäß
§ 7 Abs. 1 TMG für eigene Inhalte auf diesen Seiten nach
den allgemeinen Gesetzen verantwortlich. Nach §§ 8 bis 10 TMG sind
wir als Diensteanbieter jedoch nicht verpflichtet, übermittelte oder
gespeicherte fremde Informationen zu überwachen oder nach Umständen zu
forschen, die auf eine rechtswidrige Tätigkeit hinweisen. Verpflichtungen zur
Entfernung oder Sperrung der Nutzung von Informationen nach den allgemeinen
Gesetzen bleiben hiervon unberührt. Eine diesbezügliche Haftung ist jedoch erst
ab dem Zeitpunkt der Kenntnis einer konkreten Rechtsverletzung möglich. Bei
bekannt werden von entsprechenden Rechtsverletzungen werden wir diese Inhalte
umgehend entfernen. Unser Angebot enthält Links zu externen Webseiten Dritter,
auf deren Inhalte wir keinen Einfluss haben. Deshalb können wir für diese
fremden Inhalte auch keine Gewähr übernehmen. Für die Inhalte der verlinkten
Seiten ist stets der jeweilige Anbieter oder Betreiber der Seiten
verantwortlich. Die verlinkten Seiten wurden zum Zeitpunkt der Verlinkung auf
mögliche Rechtsverstöße überprüft. Rechtswidrige Inhalte waren zum Zeitpunkt
der Verlinkung nicht erkennbar. Eine permanente inhaltliche Kontrolle der
verlinkten Seiten ist jedoch ohne konkrete Anhaltspunkte einer Rechtsverletzung
nicht zumutbar. Bei bekannt werden von Rechtsverletzungen werden wir derartige
Links umgehend entfernen. Urheberrecht: Die durch die Seitenbetreiber
erstellten Inhalte und Werke auf diesen Seiten unterliegen dem deutschen
Urheberrecht. Beiträge Dritter sind als solche gekennzeichnet. Die
Vervielfältigung, Bearbeitung, Verbreitung und jede Art der Verwertung
außerhalb der Grenzen des Urheberrechtes bedürfen der schriftlichen Zustimmung
des jeweiligen Autors bzw. Erstellers. Downloads und Kopien dieser Seite
sind nur für den privaten, nicht kommerziellen Gebrauch gestattet. Die
Betreiber der Seiten sind bemüht, stets die Urheberrechte anderer zu beachten
bzw. auf selbst erstellte sowie lizenzfreie Werke zurückzugreifen. Medientechnische Umsetzung (inkl. Applikationen) DP-Medsystems
AG, Tulpenstraße 26, Germering bei München, info(at)dpmed.de

